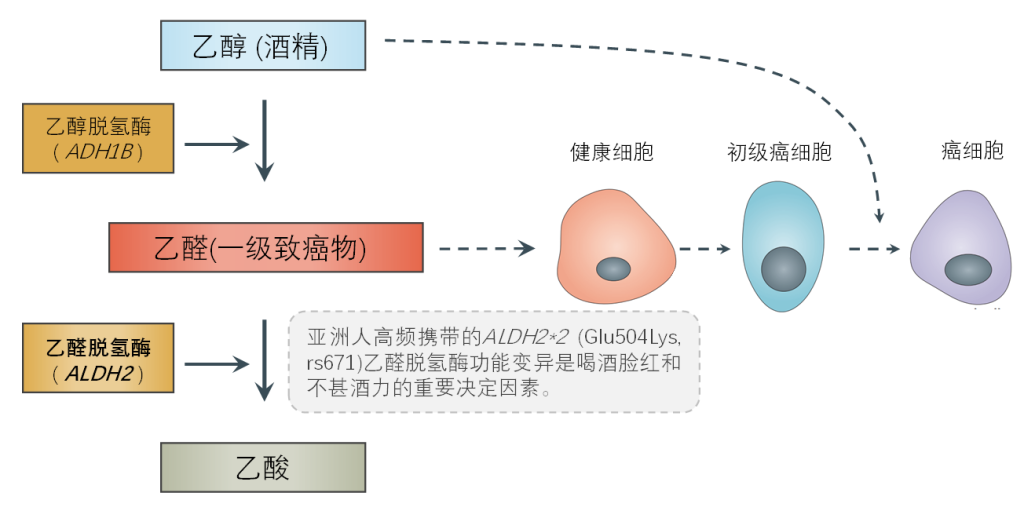
European Heart Journal | 中国首个冠心病多基因风险评分(PRS)模型建立
近日,国家心血管病中心/中国医学科学院阜外医院顾东风院士与鲁向锋教授团队成功建立我国首个冠心病多基因风险评分(PRS)模型,为冠心病风险评估和干预措施选择提供了解决方案。研究成果于2022年2月23日在线发表在心脏病研究顶级期刊《欧洲心脏杂志》(European Heart Journal,IF=29.98)[1]。

研究背景
《中国心血管健康与疾病报告2020》中提到,在中国心脑血管病患者数量达到3.3亿,每年有400多万人因心脑血管病失去生命,也就是说平均每1分钟,就有8人因心脑血管病去世。其中,脑卒中与冠心病分列单病种致死原因前两位,每5例因疾病死亡中就有2例死于心脑血管疾病,2018年我国居民因缺血性心脏病住院856万人次,因脑卒中住院772万人次,住院费高达1774亿元。脑卒中和冠心病发病率不仅呈现持续升高的趋势,还有复发率高、预后差、致残率高的特点。我国颁布了《健康中国2030规划纲要》,强化慢性病筛查和早期发现,坚持以预防为主,实现全民健康。
metaPRS模型研究路线
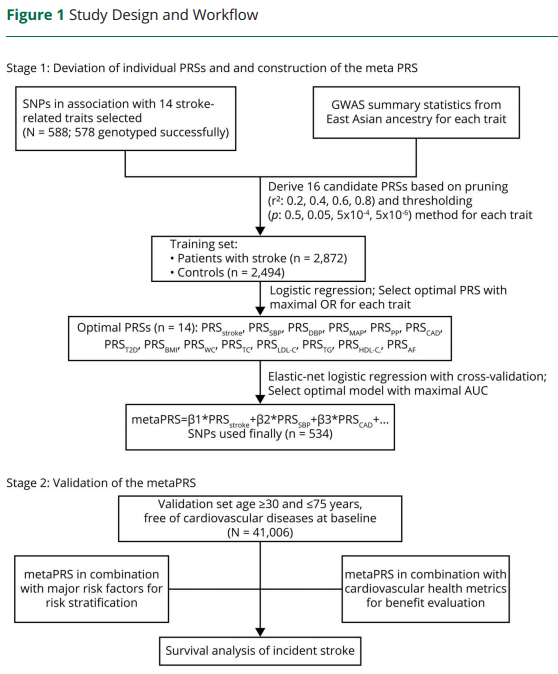
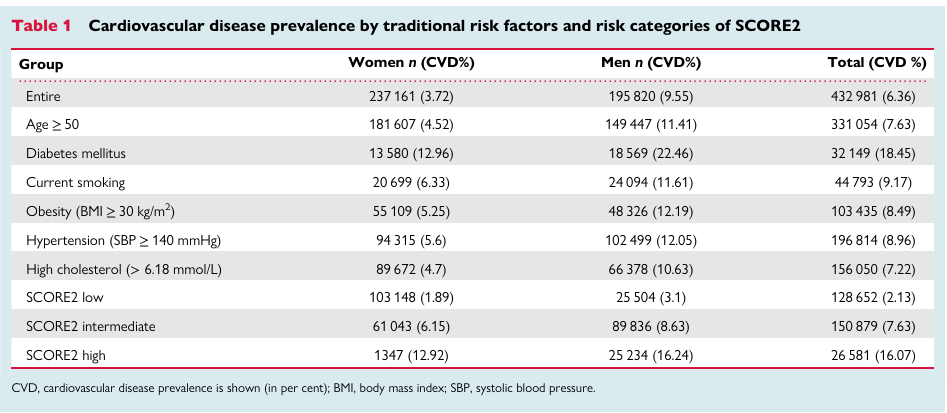
传统因素风险评估和PRS风险评分模型都具有人群特异性。国际现有的遗传评分均基于欧洲人群构建,由于不同种族人群环境危险因素和遗传背景存在显著差异,这些遗传评分对于中国人群并不适用[图1]。
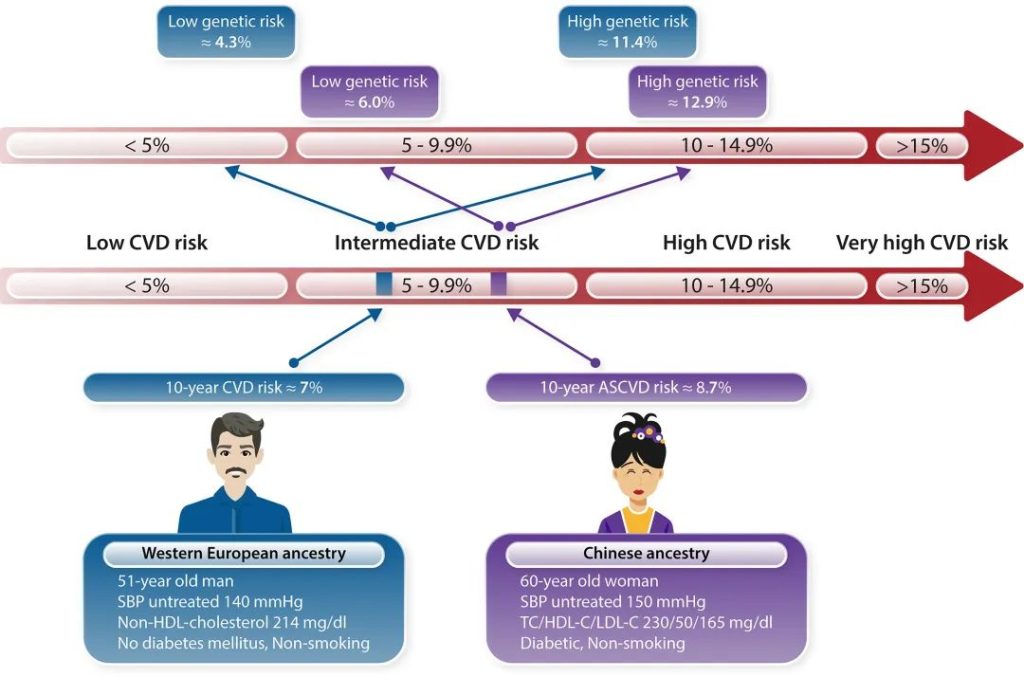
图1 传统因素风险评估模型和PRS风险评分模型都需要区分不同人群[2]
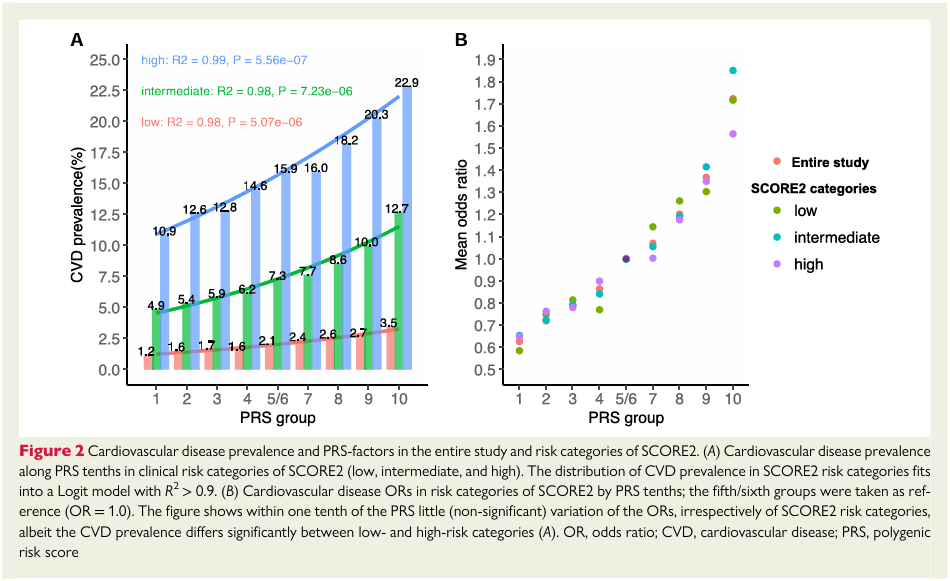
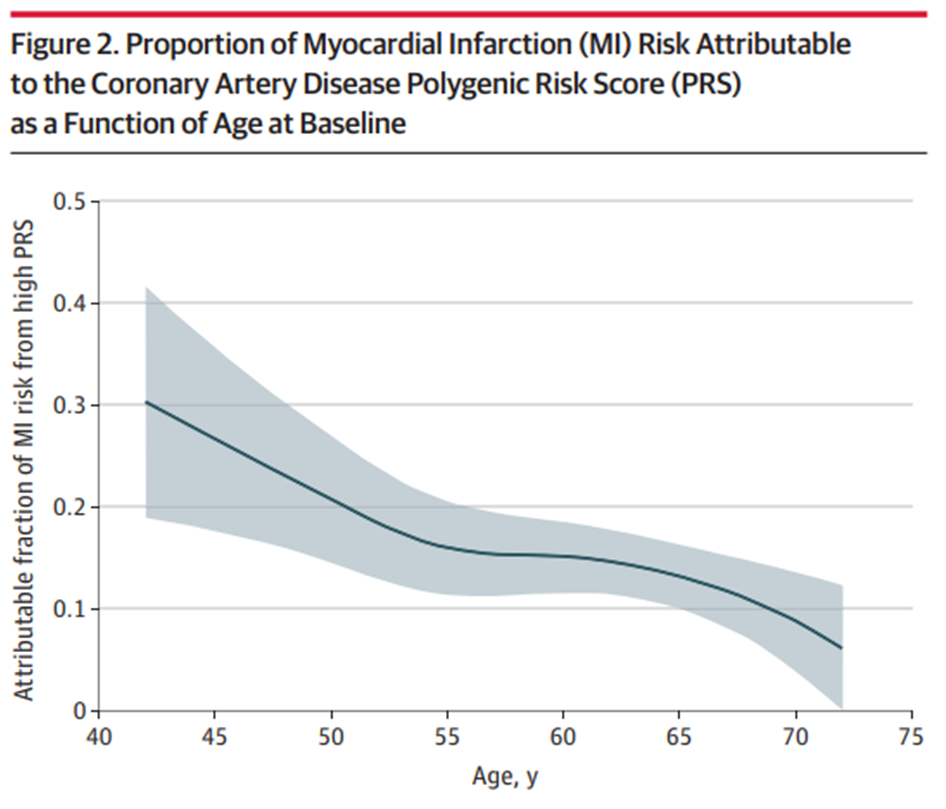
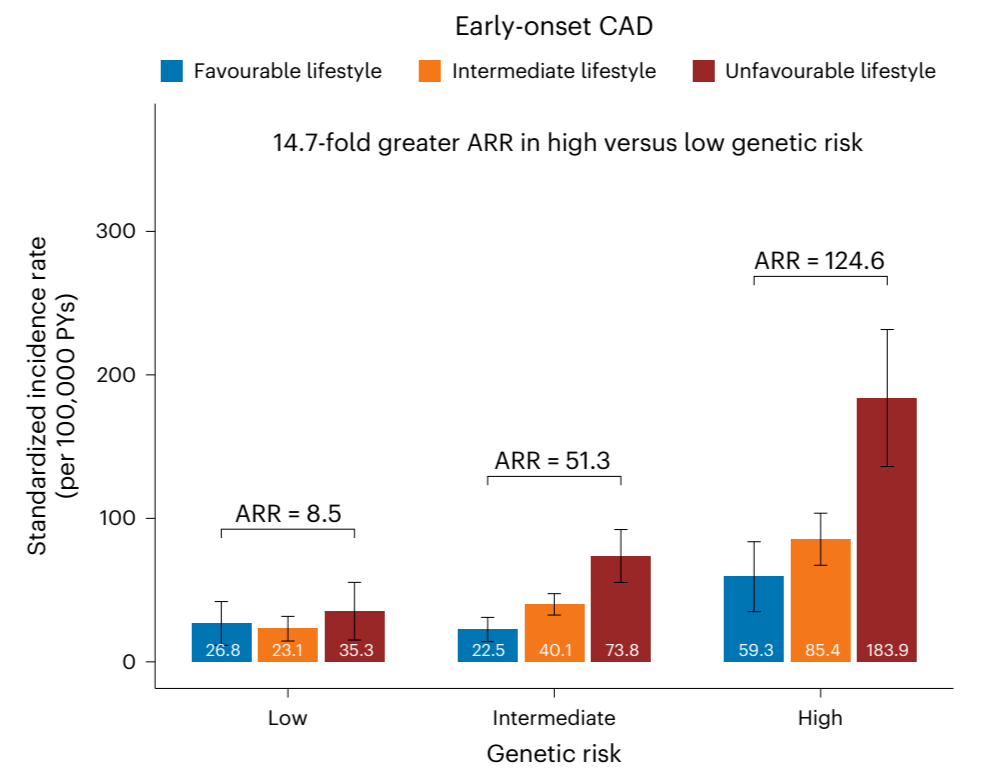
此项研究整合了中国、日本、韩国、新加坡等26万东亚人群基因组数据,确定了影响中国和东亚人群冠心病及主要危险因素的540个遗传变异,构建了首个适合中国人群的冠心病多基因风险评分模型[图2]。
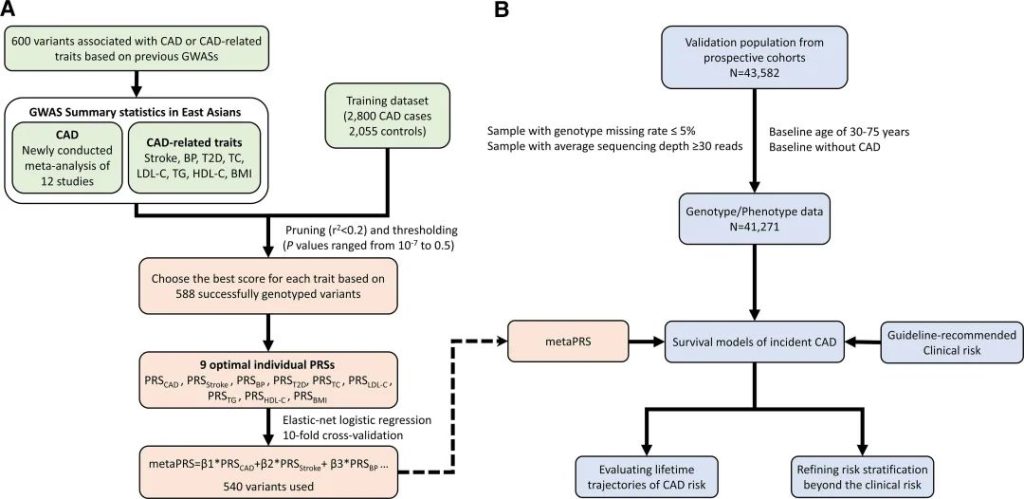
metaPRS模型的验证
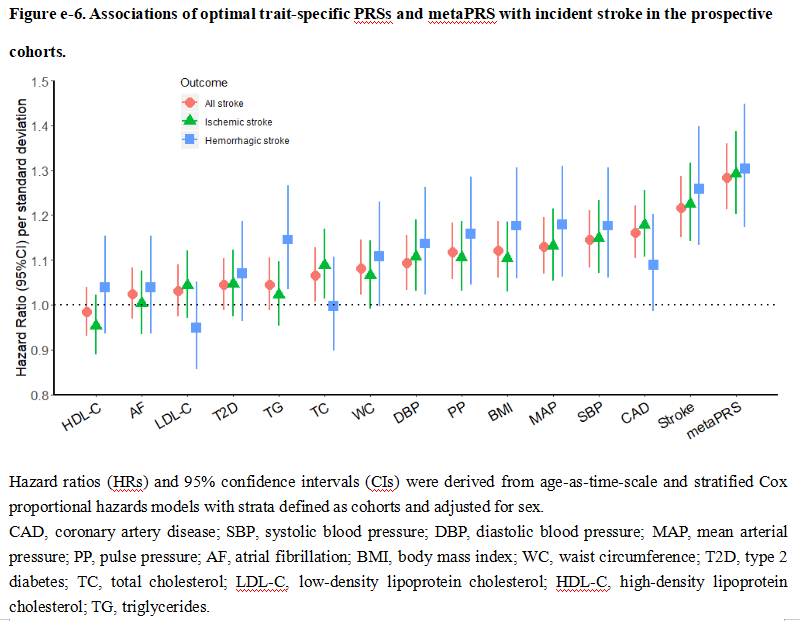
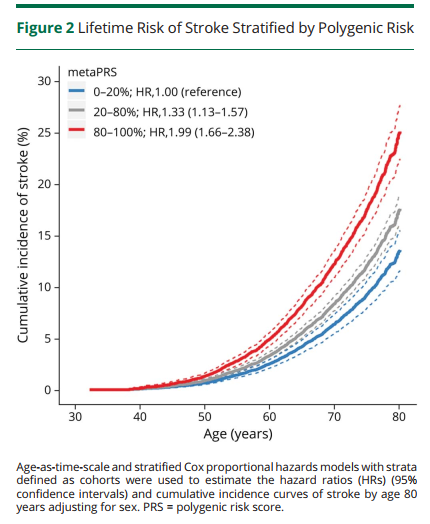
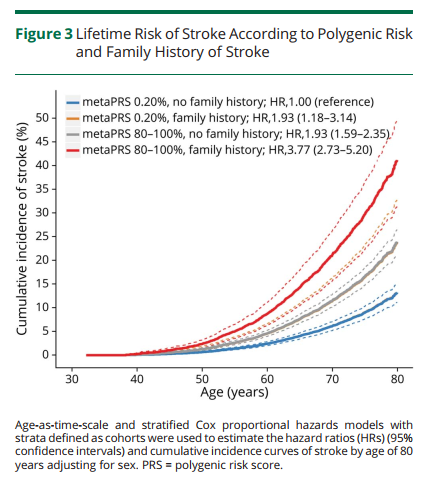
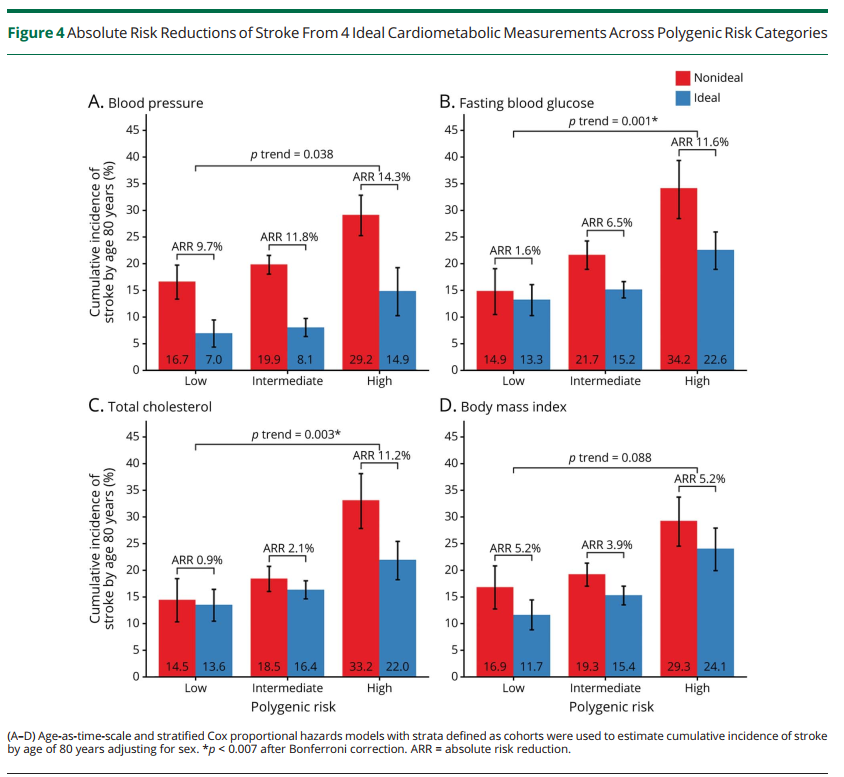
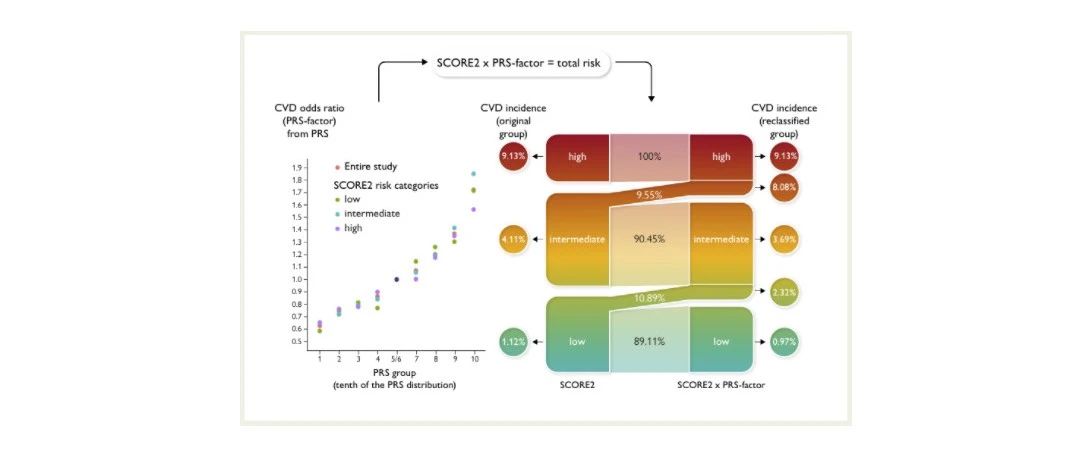
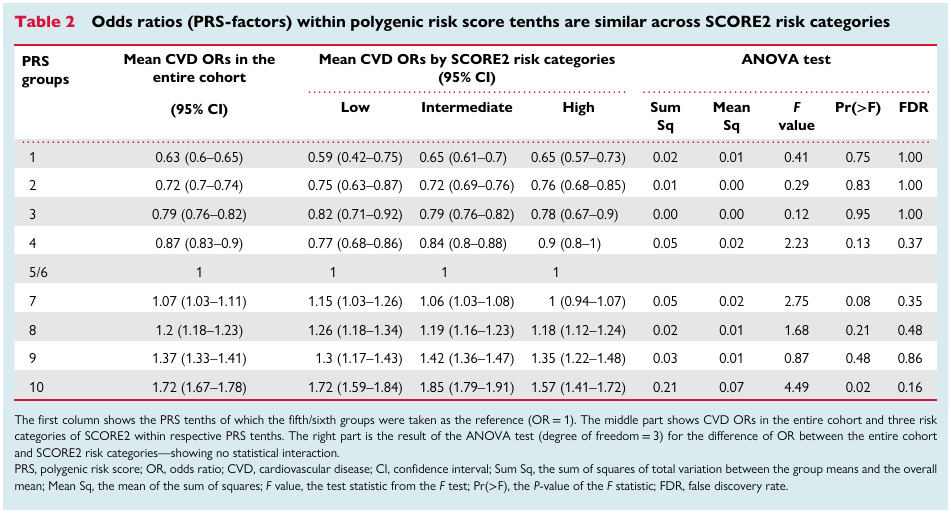
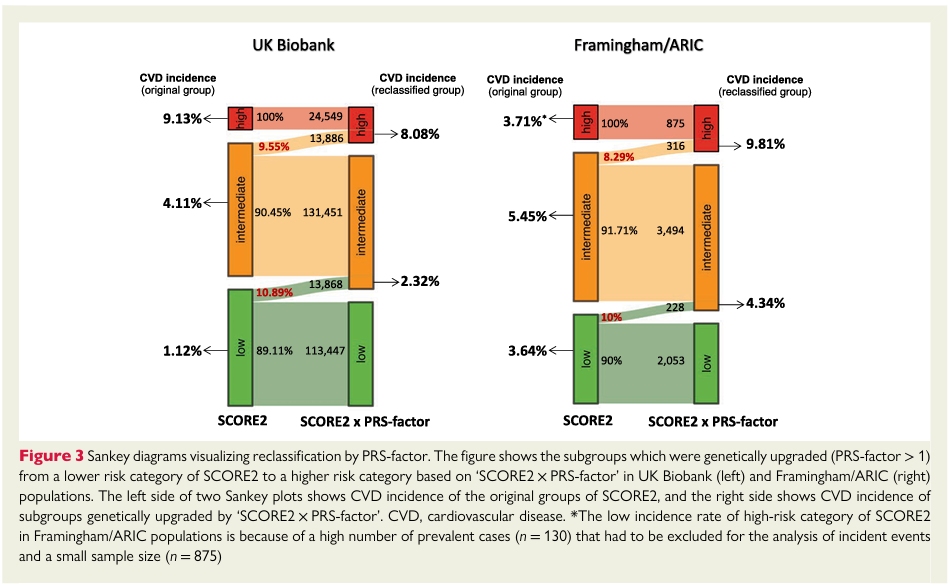
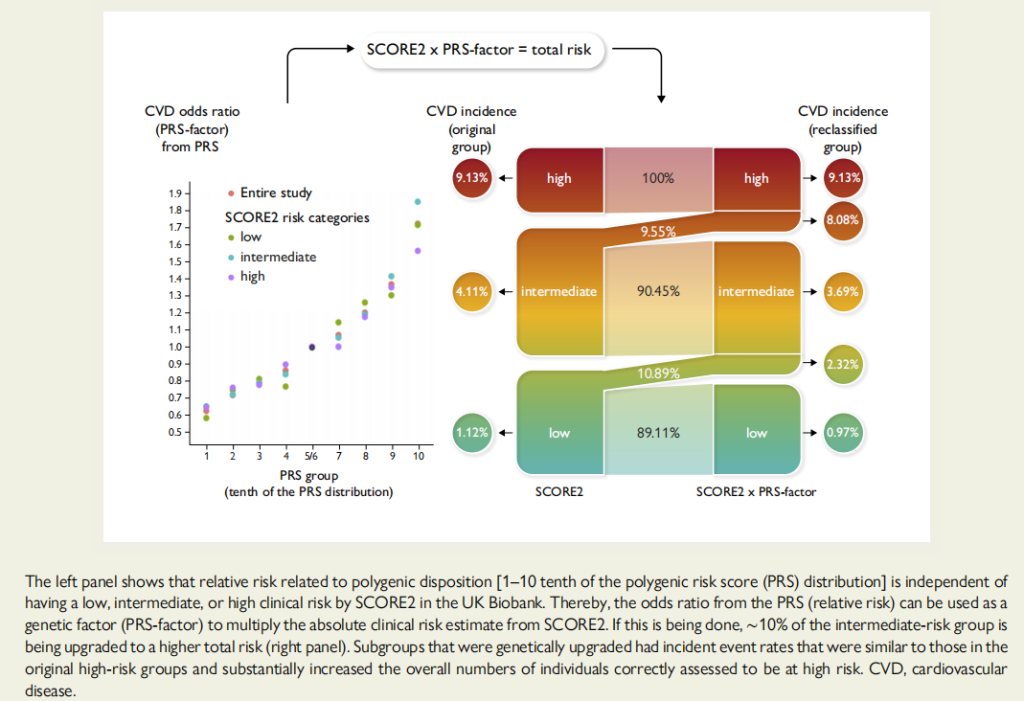
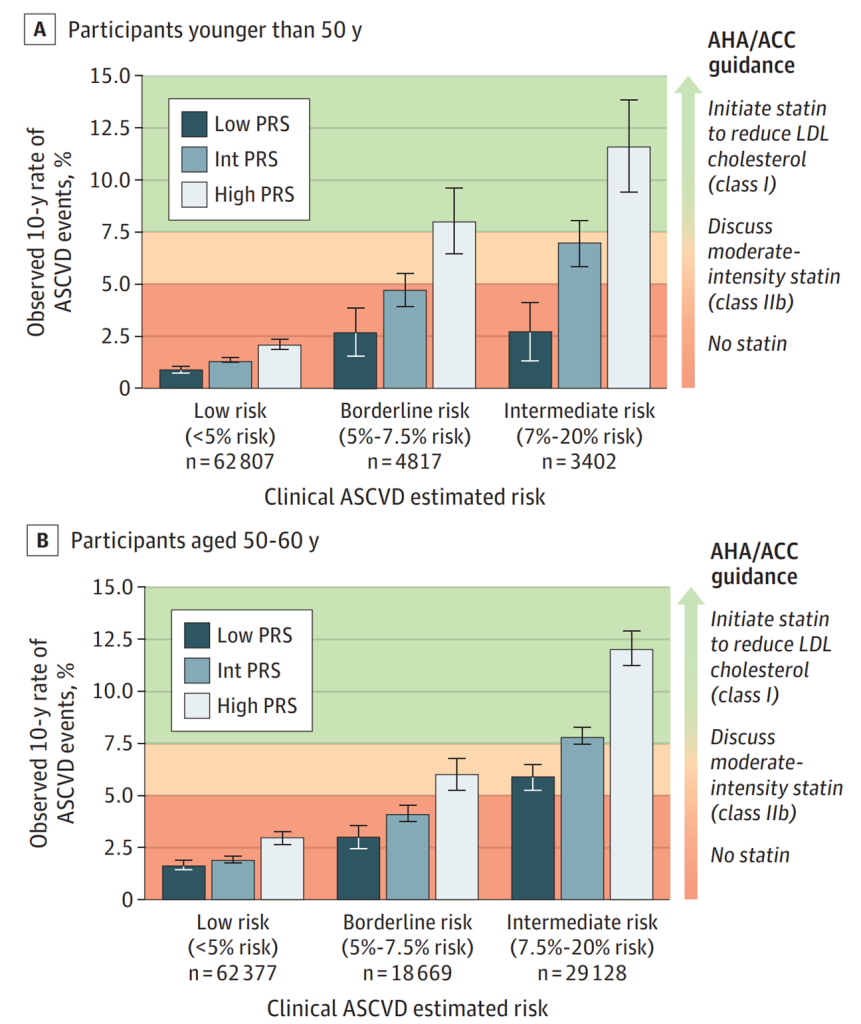
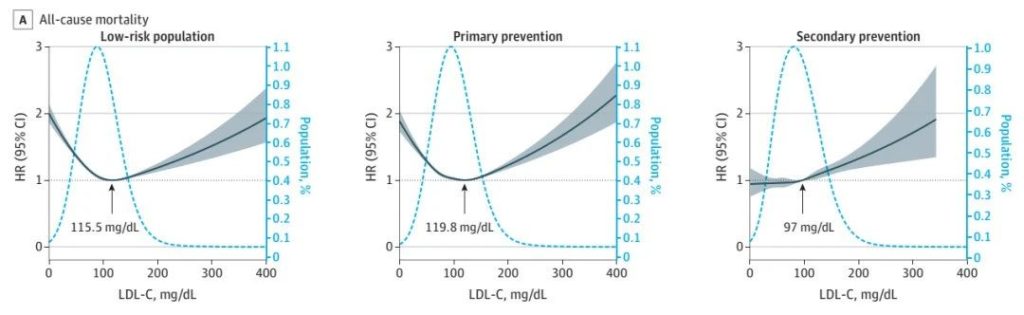
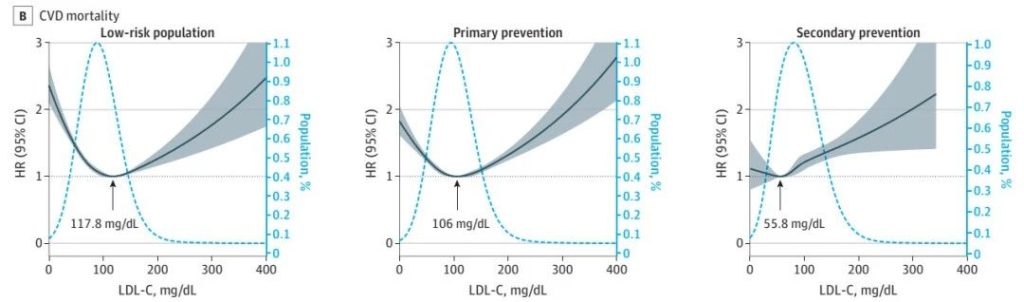
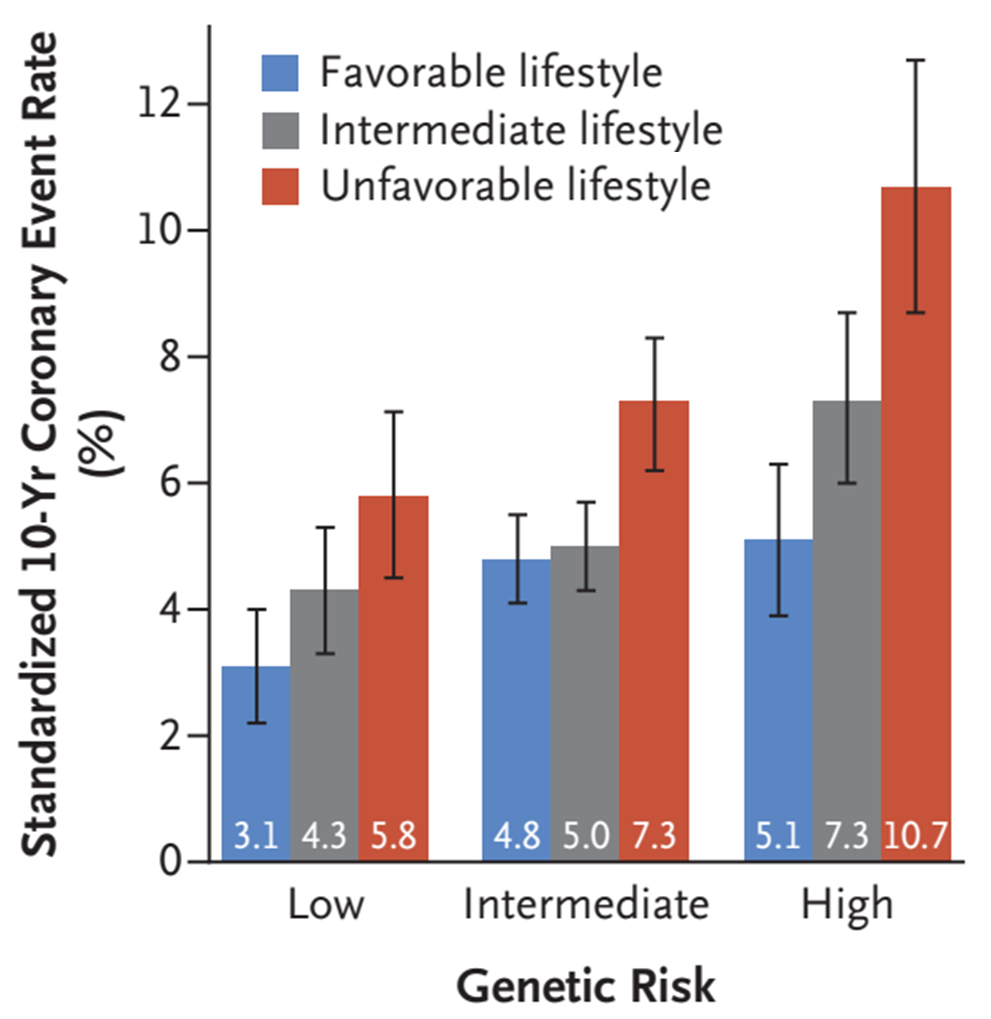
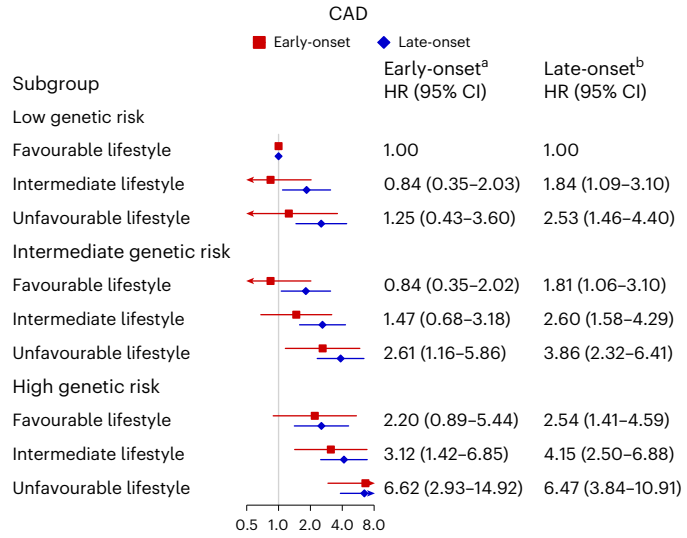
多基因风险评分可以显著改善传统临床风险的再分级能力。顾东风院士与鲁向锋教授团队在我国前瞻性随访20年的4万多人群队列中,评价和验证PRS模型对冠心病的预测价值,该模型适用中国人群,还可以显著改善传统临床风险的再分层能力,尤其是对于传统中、高临床风险患者临床决策的制定具有重要的指导意义[图3]。
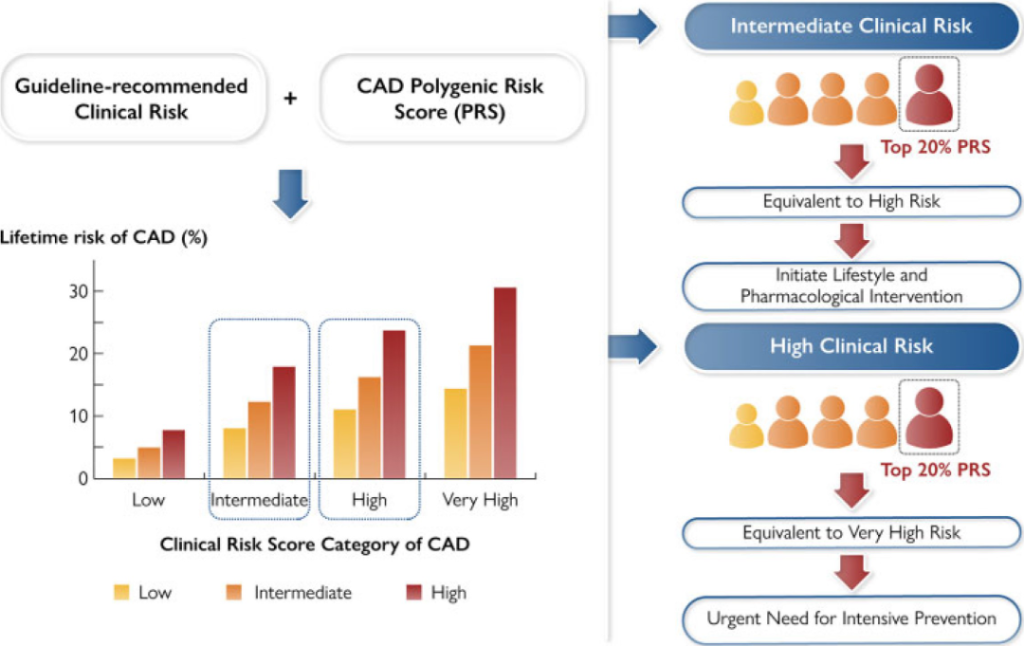
图3 多基因风险评分模型可以显著改善传统临床风险的再分级能力
研究结果和意义
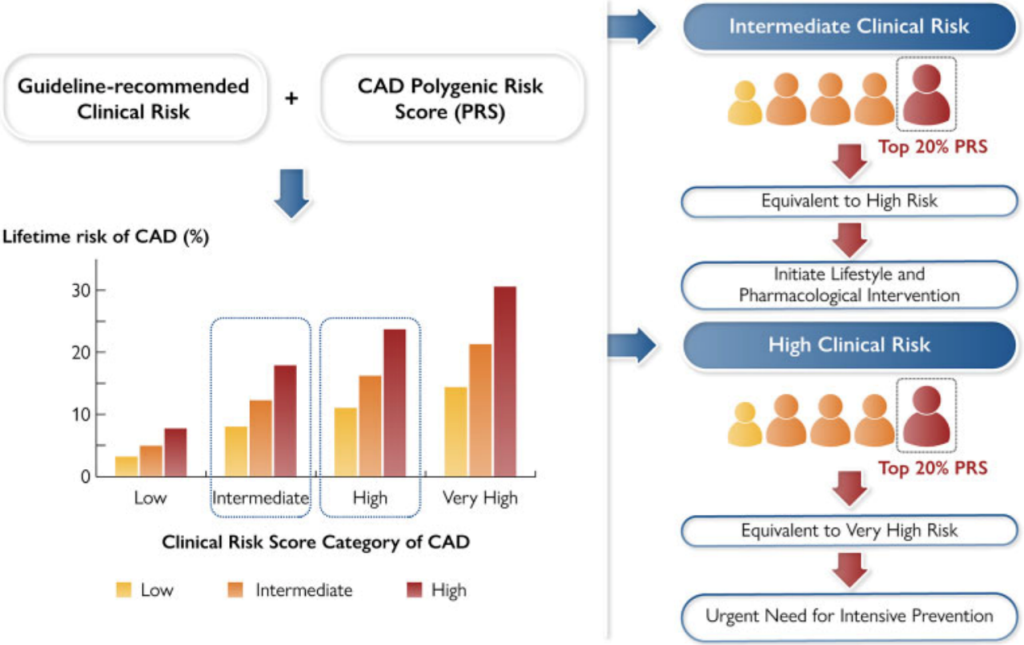
该研究进一步结合现行《中国心血管疾病风险评估与管理指南》[3]评价了多基因风险评分模型的应用价值。相比于传统的临床风险评估模型,该模型的优势在于可在生命早期、传统危险因素尚未出现之前进行风险评估,提前预测发病轨迹。《欧洲心脏杂志》同期对该评分模型在预防和临床实践中的应用价值进行了重点述评。文中指出尚未出现临床危险因素的年轻人,PRS风险评分可能是心血管风险分层的最佳模型,可以获得更好的分层和干预。对传统中、高临床风险患者,多基因风险评分可以显著改善传统临床风险的再分级能力,对临床决策的制定具有重要的指导意义。
该研究建立了我国居民冠心病高危人群早期筛查的实用性评估模型,并提出不同遗传和临床风险人群的心血管健康管理路径和方案。
现行《中国心血管疾病风险评估与管理指南》对中等传统临床风险患者也缺乏明确的干预建议。对于中等传统临床风险合并高遗传风险的患者,应启动生活方式和药物干预。高传统临床风险合并高遗传风险的患者,则需进行强化生活方式和药物治疗等干预。尤其是在我国目前心血管疾病危险因素控制率不佳的背景下,增加遗传风险的个体化评估将提升患者健康管理的顺应性。
传统临床因素与遗传因素结合,有助于实现个体化风险评估、个体化治疗,从而提升冠心病精准预测与精准防治的水平,降低我国冠心病负担。
相关研究
顾东风院士和鲁向锋教授团队多年来致力于心脑血管疾病的风险评估。2012年,在《Nature genetics》(IF=38.33)发表中国汉族人群队列研究,通过3.3万中国汉族人群队列,发现4个新的与冠状动脉疾病相关位点[4]。2015年在《Hypertension》(IF=10.19)杂志发表文章,基于2.6万中国人群队列,开展了多种与血压相关的遗传标记对高血压和心血管疾病发病风险的研究[5]。2016年在《Circulation》(IF=29.69),通过12.7万人传统危险因素中国人群队列研究,发布中国ASCVD风险评估模型China-PAR,该模型填补了中国心血管病临床风险评估的空白[6]。2017年,顾东风院士、鲁向锋教授组织发起国际最大规模跨种族血脂和冠心病研究,通过对50余万东亚和欧美人群的外显子组和基因组研究,鉴定出50个影响血脂水平的易感基因,文章发表在《Nature genetics》,为开展遗传机制研究指明了目标基因和功能位点[7]。2021年在《Neurology》(IF=9.91)杂志发表首个适用于中国人群的脑卒中多基因风险评分(PRS)模型,可用于脑卒中的早期遗传风险预测,进而指导精准防治[8]。
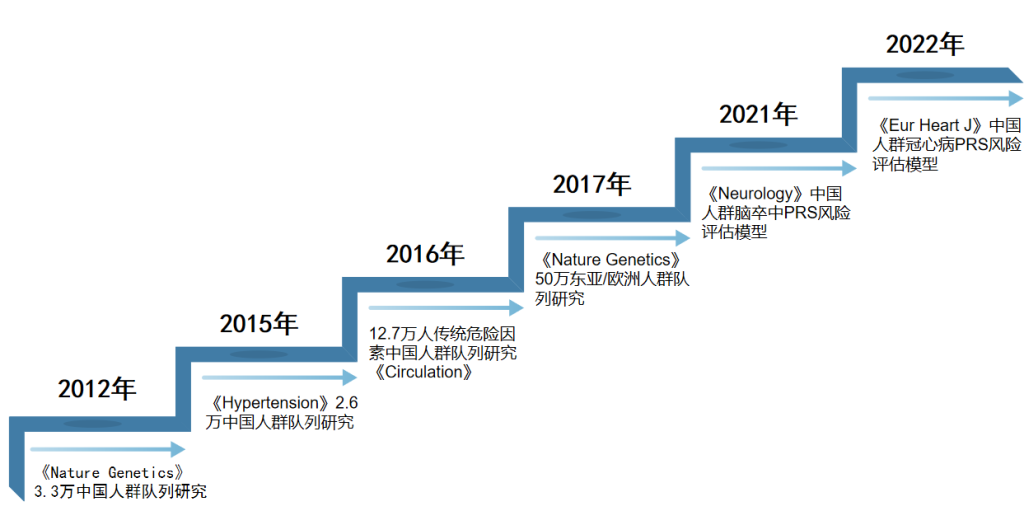
图4 研究历程
以上研究实现了科研成果的转化,开发了心脑血管疾病遗传风险检测液相基因芯片。目前我国主要依赖于传统环境危险因素开展心血管疾病风险评估,metaPRS可以对传统风险分层进一步细化,实现精细风险分层识别高风险个体,尤其是对于传统中、高临床风险患者个体化临床决策的制定具有重要的指导意义,实现临床实用性靶向干预。

参考文献:
[1] Lu X, Liu Z, Cui Q, et al. A polygenic risk score improves risk stratification of coronary artery disease: a large-scale prospective Chinese cohort study. Eur Heart J. 2022 Feb 23.
[2] Maryam Kavousi, Heribert Schunkert. Polygenic risk score: a tool ready for clinical use? Eur Heart J. 25 February 2022.
[3] 中国心血管病风险评估和管理指南编写联合委员会. 中国心血管病风险评估和管理指南[J]. 中国循环杂志,2019,34(1):4-28. DOI:10.3969/j.issn.1000-3614.2019.01.002.
[4] Lu, X., Wang, L., Chen, S. et al. Genome-wide association study in Han Chinese identifies four new susceptibility loci for coronary artery disease. Nat Genet 44, 890–894 (2012). https://doi.org/10.1038/ng.2337
[5] Lu X, Huang J, Wang L, Chen S, Yang X, Li J, Cao J, Chen J, Li Y, Zhao L, Li H, Liu F, Huang C, Shen C, Shen J, Yu L, Xu L, Mu J, Wu X, Ji X, Guo D, Zhou Z, Yang Z, Wang R, Yang J, Yan W, Gu D. Genetic predisposition to higher blood pressure increases risk of incident hypertension and cardiovascular diseases in Chinese. Hypertension. 2015 Oct;66(4):786-92. doi: 10.1161/HYPERTENSIONAHA.115.05961. Epub 2015 Aug 17.
[6] Yang X, Li J, Hu D, Chen J, Li Y, Huang J, Liu X, Liu F, Cao J, Shen C, Yu L, Lu F, Wu X, Zhao L, Wu X, Gu D. Predicting the 10-Year Risks of Atherosclerotic Cardiovascular Disease in Chinese Population: The China-PAR Project (Prediction for ASCVD Risk in China). Circulation. 2016 Nov 8;134(19):1430-1440. doi: 10.1161/CIRCULATIONAHA.116.022367. Epub 2016 Sep 28.
[7] Lu, X., Peloso, G., Liu, D. et al. Exome chip meta-analysis identifies novel loci and East Asian–specific coding variants that contribute to lipid levels and coronary artery disease. Nat Genet 49, 1722–1730 (2017). https://doi.org/10.1038/ng.3978
[8] Xiangfeng Lu, Xiaoge Niu, Chong Shen, Fangchao Liu, Zhongying Liu, Keyong Huang, Laiyuan Wang, Jianxin Li, Dongsheng Hu, Yingxin Zhao, Xueli Yang, Fanghong Lu, Xiaoqing Liu, Jie Cao, Shufeng Chen, Hongfan Li, Wuzhuang Tang, Zhanyun Ren, Ling Yu, Xianping Wu, Xigui Wu, Ying Li, Huan Zhang, Jianfeng Huang, Zhibin Hu, Hongbing Shen, Cristen J. Willer, Dongfeng Gu. Development and Validation of a Polygenic Risk Score for Stroke in the Chinese Population. Neurology Aug 2021, 97 (6) e619-e628; DOI: 10.1212/WNL.0000000000012263