Neurology|中国人群的脑卒中多基因遗传风险评分的开发和验证
研究背景
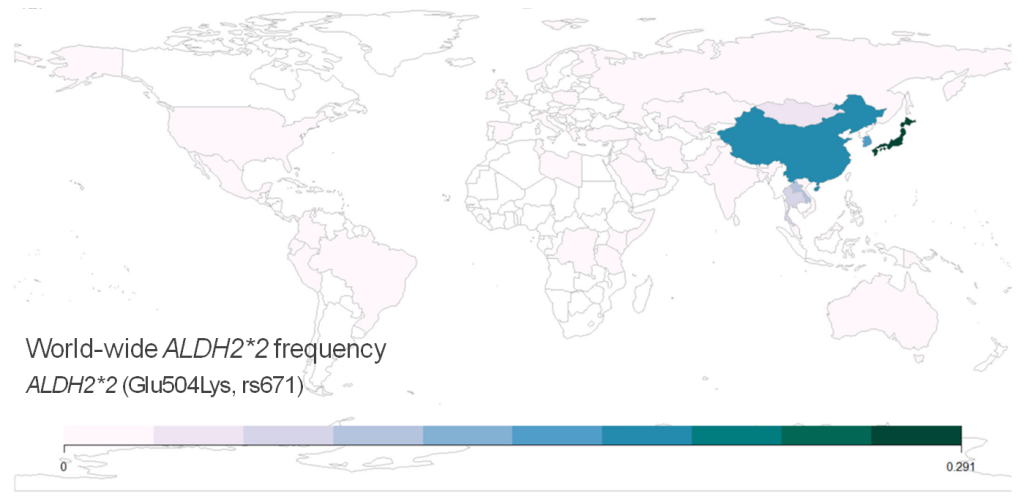
脑卒中(又称“中风”)导致的死亡正在增加并威胁着全人类健康。相比于西方国家,中国人群的脑卒中发病率以及出血性脑卒中占比更高。在中国,脑卒中是心脑血管疾病导致死亡的主要原因之一,2017年死亡人数已经达到207万。近期已有研究团队开发了欧洲人群的脑卒中多基因遗传风险评分系统(Polygenic Risk Score,PRS)并评估了其在临床应用的可行性1–6,而欧洲人群分析模型对于中国人群适用程度并不确定。中国目前心脑血管发病风险筛查方法主要是基于传统的临床危险因素,如高血压、糖尿病、血脂异常等指标,但在危险因素出现前,传统检测手段无法进行心脑血管风险评估,说明传统临床检测手段具有一定的滞后性。
因此,对中国人群构建特有的多基因遗传风险评分(PRS)模型非常重要。另外,高遗传风险个体的早期识别、健康生活方式的维持以及药物干预对中国及世界的脑卒中一级预防来说都是必要的。基于以上背景,国家心血管病中心、中国医学科学院阜外医院流行病部、北京协和医学院鲁向锋教授作为通讯作者,并与牛晓歌博士为共同第一作者于2021年8月10日正式发表于《Neurology》,名为“Development and Validation of a Polygenic Risk Score for Stroke in the Chinese Population”的文章。该研究目的是构建适用于中国人群的脑卒中多基因遗传风险评分(PRS)模型,并利用中国大规模前瞻性队列人群数据评估该模型在脑卒中风险分层和一级预防中的应用价值。

结果展示
1.构建metaPRS评分模型
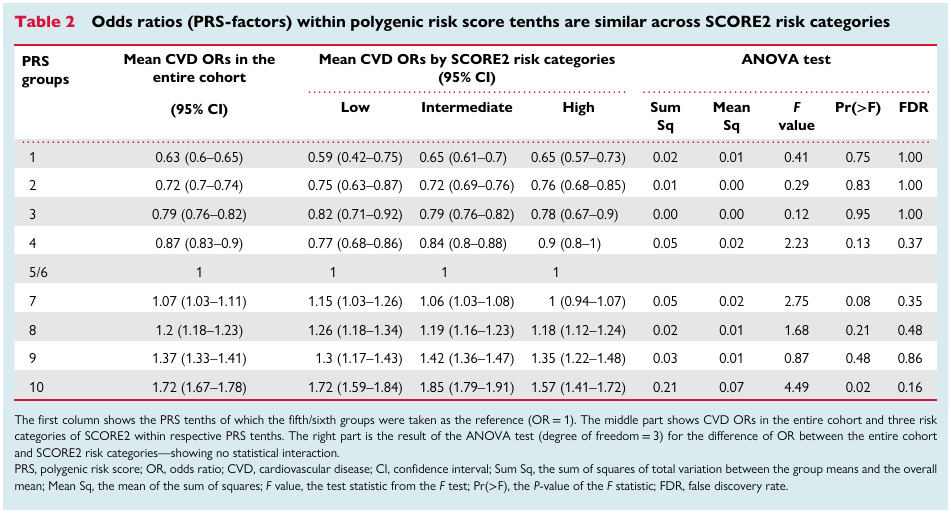
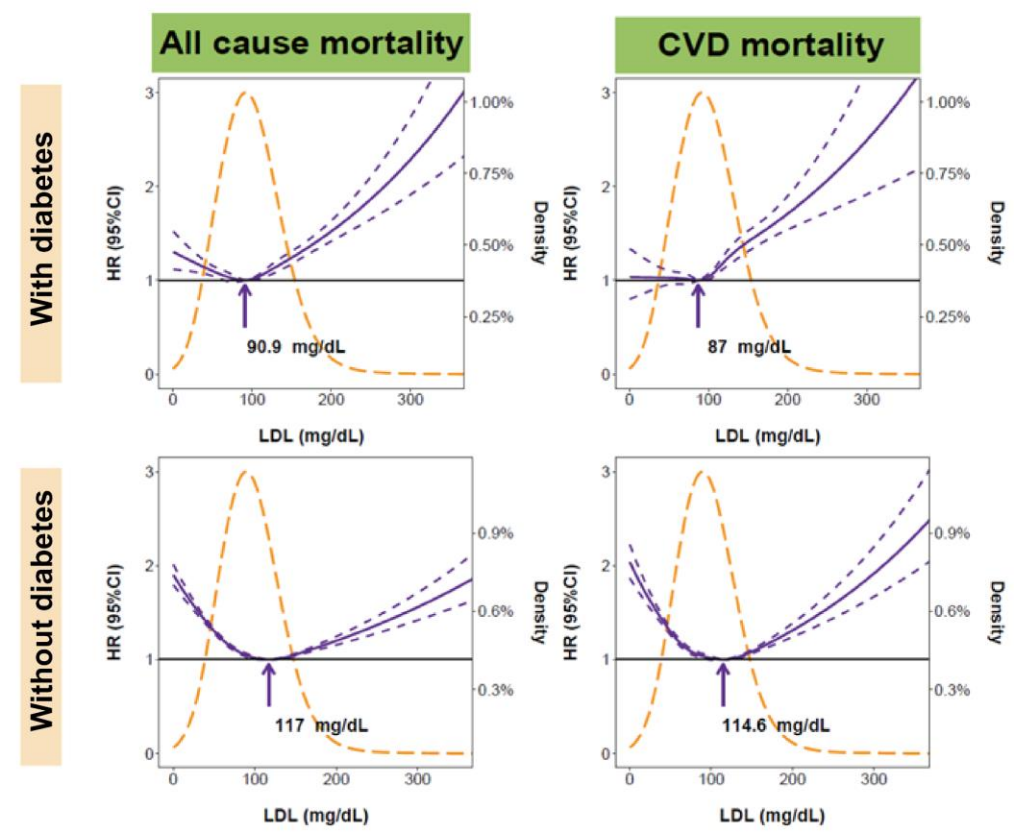
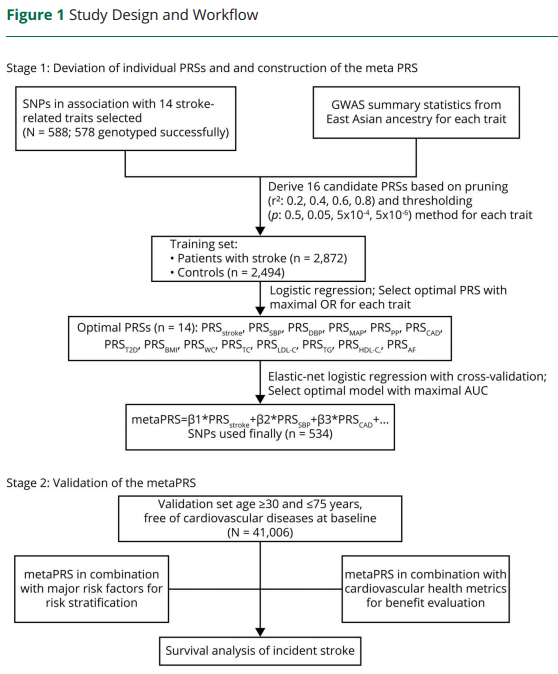
脑卒中是一种由遗传因素和环境因素导致的复杂疾病,不同人群的临床危险因素和遗传背景的差异可能会影响脑卒中风险评估。研究者定义了5个脑卒中主要的危险因素(包括高血压、血脂异常、糖尿病、肥胖以及脑卒中家族史)以及7个理想心脑血管指标(CVH,cardiovascular health)(如未治疗总胆固醇TC<200mg/dl等)。基于已有研究,全基因组关联分析(GWAS,Genome-wide association study)已经鉴定了与东亚人群脑卒中相关的42个SNP位点,以及500余个与脑卒中相关表型(血压BP、2型糖尿病T2D、脂肪、BMI、心房颤动AF)有关的SNP。利用2872个脑卒中患者以及2494个对照个体的基因型信息作为训练集,并结合先前研究的基因型信息,采用logistic回归模型选择与脑卒中关联比值(odds ratio,OR)最高的一个作为某一表型的PRS模型,一共构建了14个表型特定的PRS模型(脑卒中、冠状动脉疾病CAD、2型糖尿病T2D、心房颤动AF、收缩压SBP、舒张压DBP、平均动脉压MAP、脉压PP、BMI、腰围WC、总胆固醇TC、低密度脂蛋白胆固醇LDL-C 、甘油三酯TG和高密度脂蛋白胆固醇HDL-C )。最后利用弹性网状logistic回归模型将这14个表型的PRS模型整合为脑卒中多基因遗传风险综合评分(metaPRS),该模型包含534个SNP位点。(Figure 1)
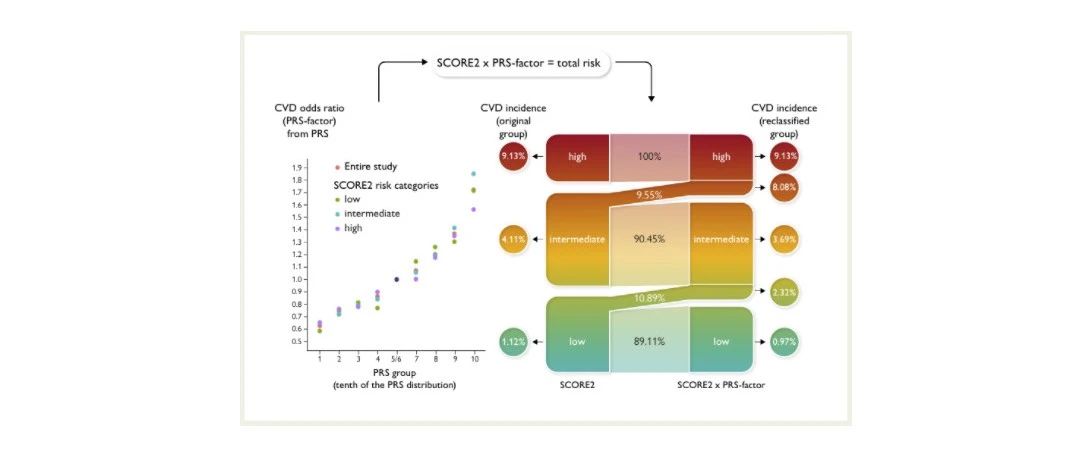
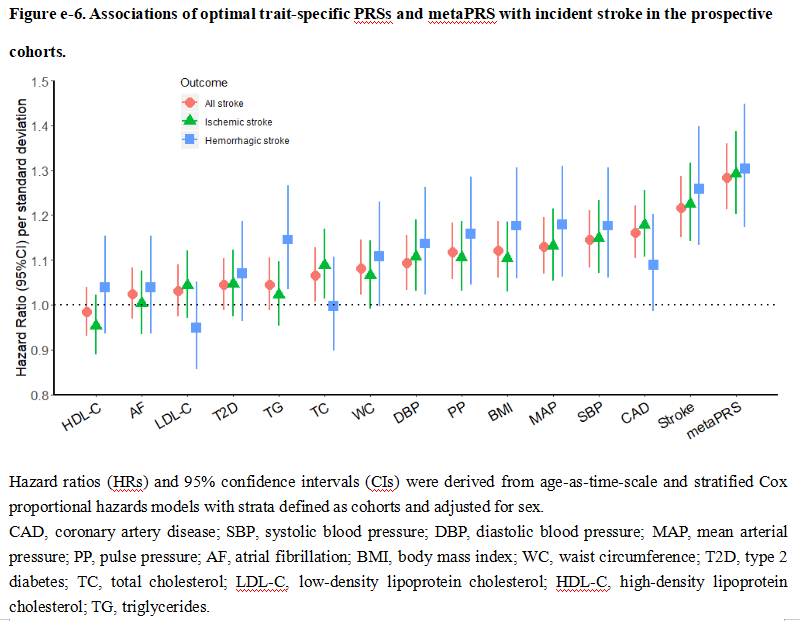
研究团队同时利用41,006例中国大规模前瞻性队列人群的基因型信息作为验证集对metaPRS模型进行验证。经过367,750人年随访(平均单个随访9.0年),1227人在80岁发生了脑卒中。通过验证集发现,相比其他14个表型的PRS模型,metaPRS与脑卒中的相关性最显著(Figure e-6)。另外所有脑卒中、缺血性卒中和出血性卒中的风险比(Hazard ratios:HRs)(95% CIs)分别为1.28(1.21-1.36)、1.29(1.20-1.39)和1.30 (1.17-1.45)。综合了脑卒中家族史、高血压等主要危险因素后,脑卒中metaPRS的HRs仅略微降低。
2.利用验证集数据预测脑卒中遗传终生风险
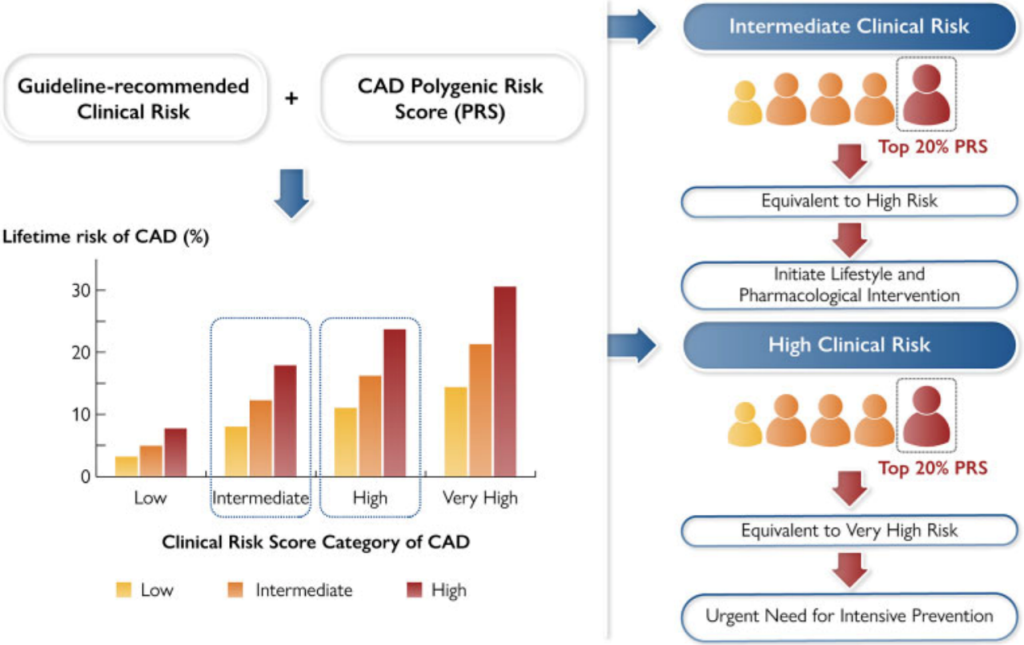
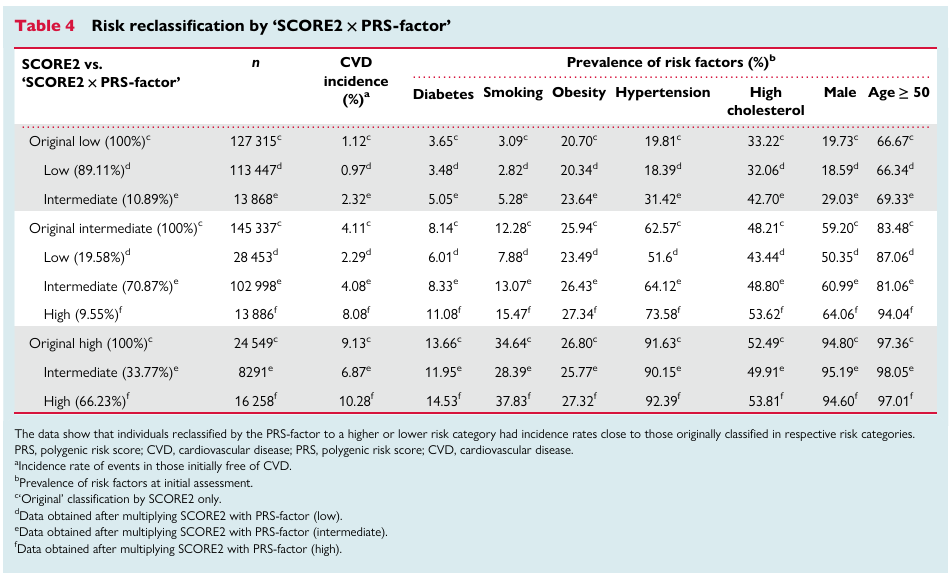
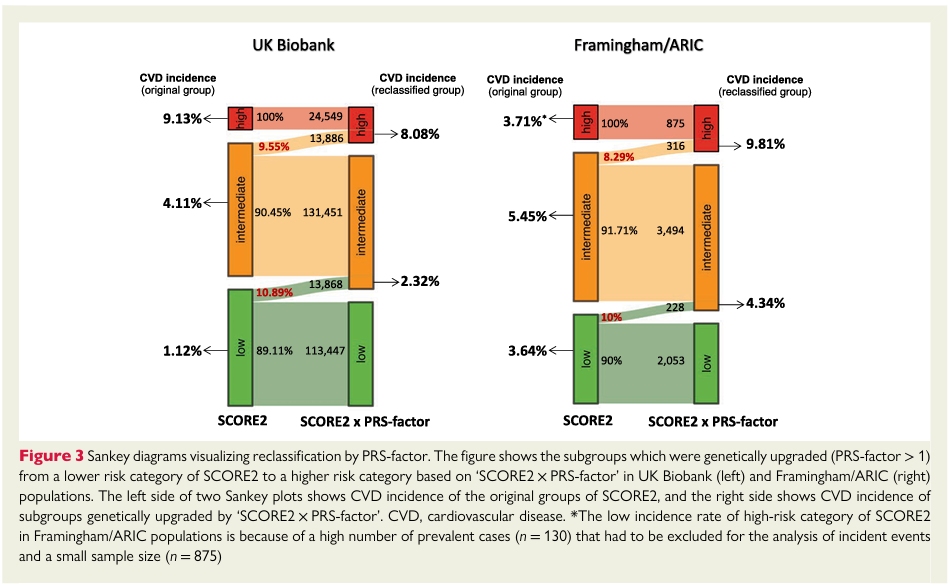
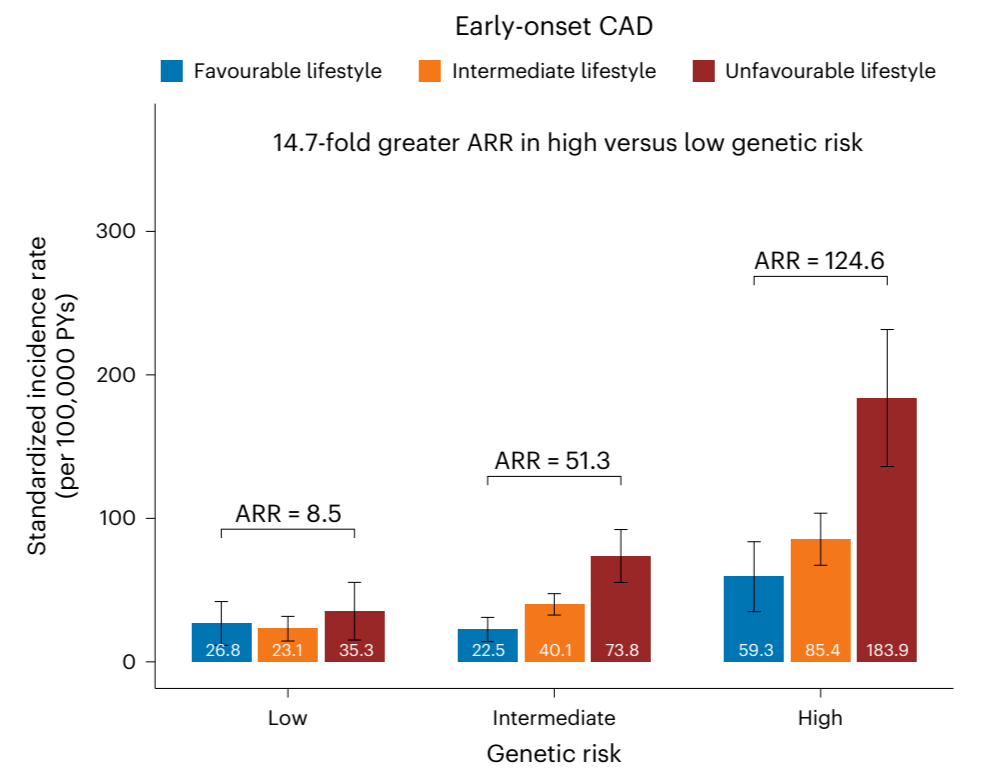
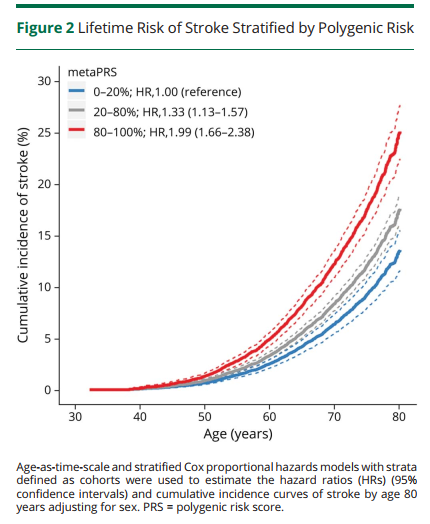
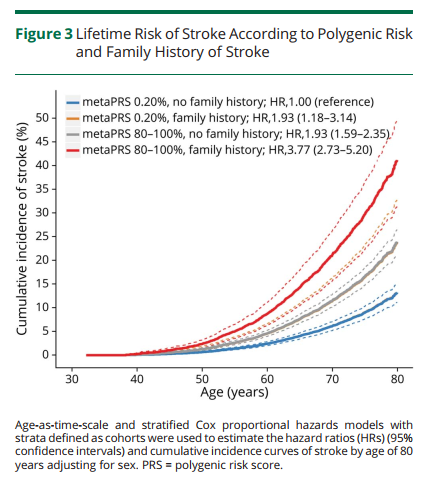
研究团队通过metaPRS评分显著的五分位点梯度对脑卒中风险进行分层(低危0-20%、中危20%-80%、高危80-100%),分层后发现高危遗传风险个体发生脑卒中的风险比(HRs)是低危遗传风险个体的2倍左右,且脑卒中终生风险也接近2倍(Figure 2),高、低危遗传风险个体脑卒中终生风险分别为:25.2%(95% CI: 22.5%-27.7%),13.6%(95% CI: 11.6%-15.5%)。另外,5种主要危险因素也被证明与脑卒中事件显著相关。综合遗传因素和脑卒中家族史考虑,在低危遗传风险并无脑卒中家族史的个体中,脑卒中终生风险为13.2% (95% CI: 11.1%-15.1%)。相反地,高危遗传风险并具有脑卒中家族史的个体,脑卒中终生风险高达41.1%(95% CI: 31.4%-49.5%)(Figure 3)。
3.维持理想CVH指标能够抵消高危遗传风险
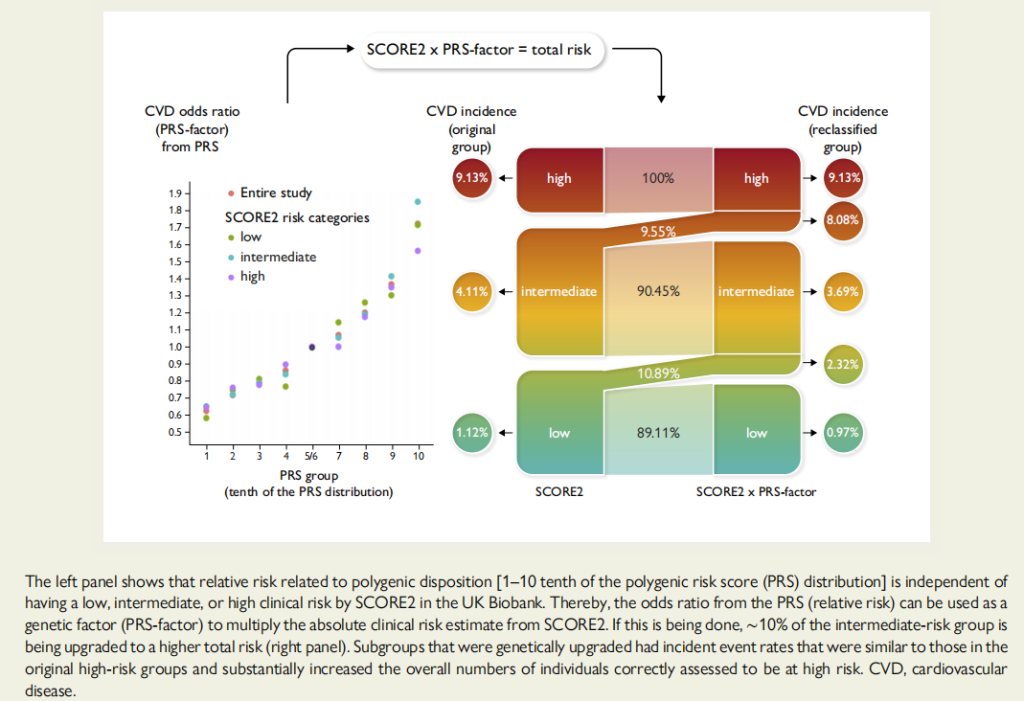
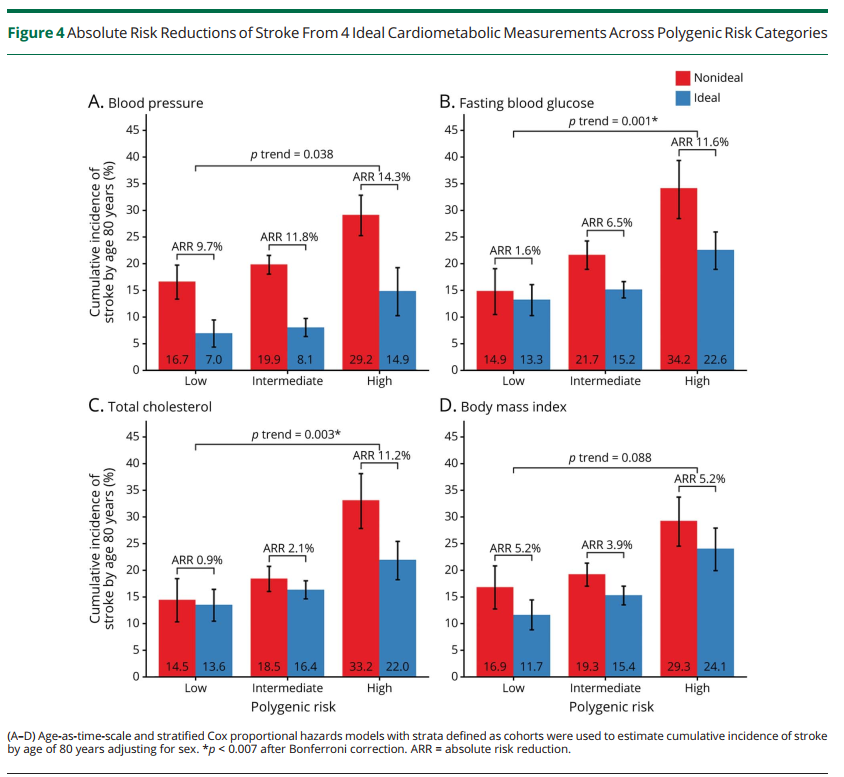
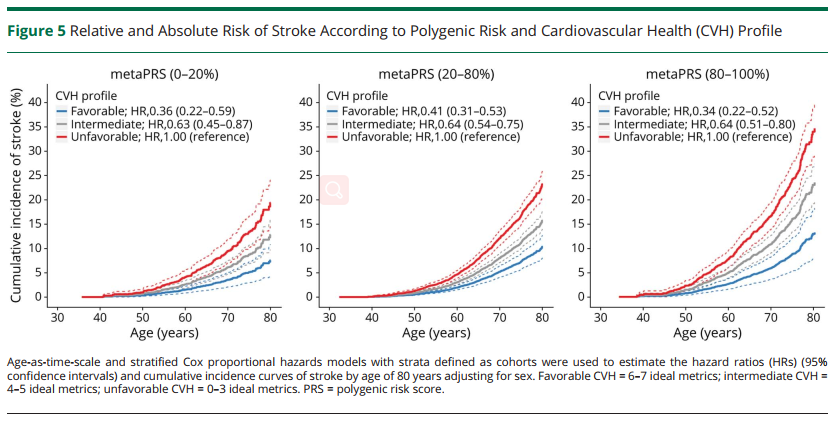
最后研究团队还调查了通过维持单个或者结合多个理想的心血管健康指标CVH能够很大程度上降低高危遗传的终生风险。在7个CVH指标中,理想的血压(HRs 0.39 95% CIs:0.33-0.46)和空腹血糖(HRs 0.67 95% CIs:0.59-0.75)与脑卒中均有显著相关性,并且这两个指标在低危、中危、高危遗传风险分层中,降低脑卒中终生风险效果最好(Figure 4),即有显著的绝对危险度降低(Absolute Risk Reduction, ARR)。另外结合多个理想CVH评估脑卒中终生风险降低效果,当个体具有高危遗传风险时,拥有良好的CVH指标(6-7个健康指标)的脑卒中终生风险比拥有不良CVH指标(0-3个健康指标)的脑卒中终生风险降低了21.4%(Figure 5)。又相较于低危遗传风险个体来说,高危遗传风险个体由于理想CVH指标的维持终生风险的绝对危险度降低(ARR)是低危的1.8倍左右,说明高危遗传风险个体控制CVH指标,收获的效果比低危遗传风险个体更为明显(Figure 5)。
结果和结论
研究团队基于中国大规模前瞻性队列人群开发了metaPRS模型,并结合主要临床危险因素和心血管健康指标CVH对脑卒中风险预测性能进行了评估。metaPRS单独或与主要临床危险因素相结合能够将个体的脑卒中终生风险分层。此外,高危遗传风险个体维持理想的CVH指标相较于低危个体能够更显著地降低发生脑卒中的风险。
该研究构建了metaPRS多基因遗传风险综合评分方法并能对个体发生脑卒中的遗传发病风险进行分层,并在生命早期筛查出遗传风险较高的人群。metaPRS评分模型将有助于开展脑卒中早期风险预测,并建议高危人群进行个性化药物干预和生活方式改善,从而降低脑卒中死亡率,对脑卒中一级预防具有重要意义。
参考文献:
1. Ibrahim-Verbaas CA, Fornage M, Bis JC, et al. Predicting stroke through genetic risk functions: the CHARGE Risk Score Project. Stroke 2014;45:403-412.
2. Malik R, Bevan S, Nalls MA, et al. Multilocus genetic risk score associates with ischemic stroke in case-control and prospective cohort studies. Stroke 2014;45:394-402.
3. Tada H, Shiffman D, Smith JG, et al. Twelve-single nucleotide polymorphism genetic risk score identifies individuals at increased risk for future atrial fibrillation and stroke. Stroke 2014;45:2856-2862.
4. Rutten-Jacobs LC, Larsson SC, Malik R, et al. Genetic risk, incident stroke, and the benefits of adhering to a healthy lifestyle: cohort study of 306 473 UK Biobank participants. BMJ 2018;363:k4168.
5. Abraham G, Malik R, Yonova-Doing E, et al. Genomic risk score offers predictive performance comparable to clinical risk factors for ischaemic stroke. Nat Commun 2019;10:5819.
6. Said MA, Verweij N, van der Harst P. Associations of Combined Genetic and Lifestyle Risks With Incident Cardiovascular Disease and Diabetes in the UK Biobank Study. JAMA cardiology 2018;3:693-702.
原文链接:
https://n.neurology.org/content/97/6/e619